
ATOM VE ATOMLA İLGİLİ İLK TEMEL BİLGİLER
Atomlarla ile İlgili Temel Gerçekler
- Fiziksel dünya, çeşitli atom altı veya temel parçacıkların kombinasyonlarından oluşur ve bunlar, maddenin en küçük yapı taşlarıdır.
- Atomlar, bir atom çekirdeği ve bir elektron bulutu olmak üzere iki kısımdan oluşur.
- Elektronların sayısı ve elektron bulutundaki dizilişleri, atomların kimyasal davranışlarından sorumludur.
- Bir elementin nükleer (çekirdeksel) özellikleri (atom kütlesi, çekirdek kesit alanı) proton sayısı (atom numarası) ve nötron sayısı (nötron sayısı) ile belirlenir.
- Nükleer kararlılık, bir izotopun kararlılığını belirlemeye yarayan bir kavramdır. Bir izotopun kararlılığını belirlemek için nötronların protonlara oranını bulmak gerekir. Bir izotopun kararlılığını belirlemek için nötron/proton (N/Z) oranını kullanabilirsiniz.
- Kararlı çekirdekler oluşturan yalnızca belirli nötron ve proton kombinasyonları vardır.
- Kararsız çekirdekler kendilerini stabilize etmek için nükleer bozunmaya (radyoaktif bozunma) maruz kalmalıdır ve bu rastgele ve doğal bir süreçtir.
- Bir maddenin 1 molündeki (12 gram karbona eşit olan ağırlık) atom sayısı, 6.022 x 1023 olan Avogadro sabitine eşittir.
Fiziksel dünya, çeşitli atom altı parçacıkların kombinasyonlarından oluşur. Bunlar maddenin en küçük yapı taşlarıdır. Karanlık madde dışındaki tüm maddeler, atomlardan oluşan moleküllerden meydana gelir. Atomlar, elektrik yüklü parçacıklarını salmaksızın bölünebilen sıradan maddenin en küçük bileşenleridir. Atomlar iki kısımdan oluşur. Bir atom çekirdeği ve bir de elektron bulutu. Elektronlar atom çekirdeğinin etrafında döner. Çekirdeğin kendisi genellikle proton ve nötronlardan oluşur, ancak bunlar bile bileşik nesnelerdir. Protonlar ve nötronların içlerine girdiğimizde orada kuarkları buluruz.
Atomları inceleyen bilime atom fiziği denir. Atom ve nükleer fiziğin aynı olmadığını unutmayın. Atom fiziği terimi, standart İngilizce'de atomik ve nükleer kelimelerinin eşanlamlı olarak kullanılmasından dolayı genellikle nükleer enerji ile ilişkilendirilir. Bununla birlikte, fizikçiler atomik ve nükleer fizik arasında ayrım yaparlar. Atom fiziği, atomu bir çekirdek ve elektronlardan oluşan bir sistem olarak ele alır. Nükleer fizik, çekirdeği nükleonlardan (protonlar ve nötronlar) oluşan bir sistem olarak ele alır. Temel fark ölçektedir. Atom terimi 1Å = 10-10 m ile ilgilenirken, burada Å bir ångström'dür (Anders Jonas Ångström'e göre), nükleer terimi 1 femtometre = 1fermi = 10-15m.
Atom fiziği, atomları izole edilmiş bir elektron sistemi ve bir atom çekirdeği olarak inceleyen fizik alanıdır. Temel olarak elektronların çekirdek etrafındaki dizilişi ve bu dizilişlerin değiştiği süreçlerle ilgilenir. Bu, nötr atomların yanı sıra iyonları da içerir ve aksi belirtilmedikçe, bu tartışmanın amaçları doğrultusunda, atom teriminin iyonları da kapsadığı varsayılmalıdır. Atom fiziği ayrıca moleküllerin fiziğini anlamaya yardımcı olur, ancak moleküler fizik aynı zamanda moleküllerin fiziksel özelliklerini de açıklar.
Atomların Özellikleri
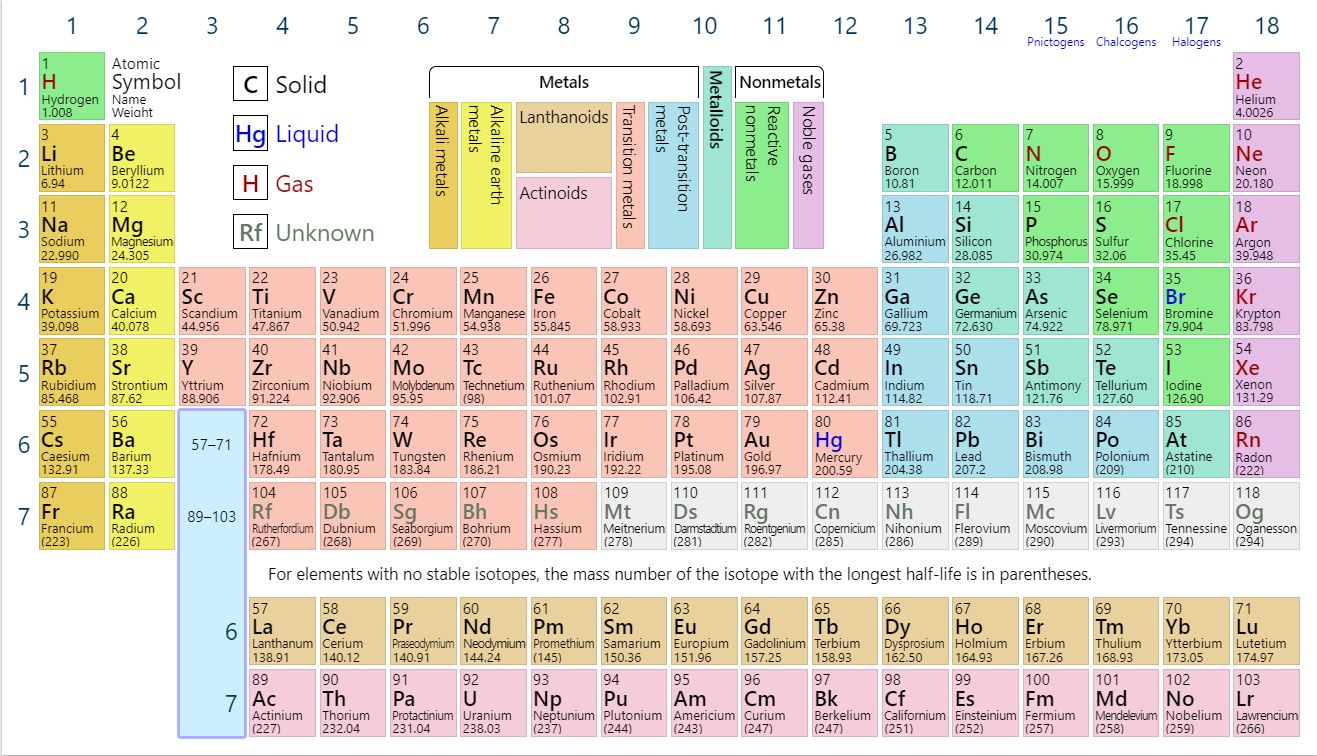
Her katı, sıvı, gaz ve plazma nötr veya iyonize atomlardan oluşur. Atomun kimyasal özellikleri proton sayısıyla, aslında elektronların sayısı ve dizilişiyle belirlenir. Bu elektronların konfigürasyonu kuantum mekaniğinin ilkelerini takip eder. Her bir elementin elektron kabuklarındaki, özellikle de en dıştaki saçak olarak kabul edilen kabuktaki elektronların sayısı, kimyasal bağlanma davranışını belirleyen birincil faktördür. Periyodik tabloda, elementler artan atom numarasına göre listelenmiştir.
Atomların Kimyasal Özellikleri
Bir atomun çekirdeğindeki protonların toplam sayısı, atomun atom numarası olarak adlandırılır ve Z sembolü ile gösterilir.
Z= Atom Numarası = Proton Sayısı
Elektriksel olarak nötr bir atomdaki elektronların sayısı, çekirdekteki protonların sayısı ile aynıdır. Bu nedenle, çekirdeğin toplam elektrik yükü +Ze'dir, burada e (temel elektrik yükü) 1,602 x 10-19 coulombs eşittir. Her bir elektron, pozitif nükleer yük ve atomdaki diğer (Z – 1) negatif elektronlar tarafından üretilen elektrik alanlarından etkilenir.
Bir atomdaki elektronların hepsinin temel durumda yoğunlaşması yerine farklı enerji seviyelerini işgal etmesini gerektiğini söyleyen Pauli dışlama ilkesidir. Çok elektronlu atomların temel durumdaki elektronların sıralanması en düşük enerji durumuyla (temel durum) başlar. Enerji durumu elektronların her birine benzersiz bir kuantum sayıları seti atanana kadar kademeli olarak yükselir. Bu gerçeğin elementlerin periyodik tablosunu oluşturmak için önemli çıkarımları vardır.
Nükleer Özellikler
Atom çekirdeğinin özellikleri (atom kütlesi, çekirdek kesit alanı) protonların sayısı ve nötronların sayısı tarafından belirlenir. Özellikle nükleer kesitlerin, N nötron numaralı nüklitten N+1 nötron numaralı nüklide kadar pek çok mertebede değişebileceği belirtilmelidir. Örneğin, tek nötron sayılarına sahip aktinitler genellikle bölünebilir (yavaş nötronlarla bölünebilir), nötron sayıları çift olan aktinitler ise bölünemez (ancak hızlı nötronlarla bölünebilir). Pauli dışlama ilkesi nedeniyle, çift sayıda protona ve çift sayıda nötrona sahip ağır çekirdekler, 'çift spin' oluşumu sayesinde çok kararlıdır. Öte yandan, proton ve nötron sayıları tek olan çekirdekler çoğunlukla dengesizdir.
Nüklit Nedir?
Nüklit ya da nükleer tür; atom numarası (Z), kütle numarası (A) ve nükleer enerji durumuna göre nitelenen herhangi bir atom türüdür. Bu nitelemede; atom numarasını oluşturan proton sayısı ve proton sayısıyla birlikte kütle numarasını oluşturan nötron sayısı (N) değerlendirilirken, söz konusu enerji durumunun yarı ömrü de gözlem yapmayı sağlayacak kadar (genellikle 10-10 saniyeden) uzun olmalıdır.
Levent Aslan
Bu kitabın imzalı bir fiziki kopyasına sahip olmak için altta bulunan banka bilgilerine ödeme yaptıktan sonra ödeme bildiriminde bulunabilirsiniz










































Yorum Yap