
ATOMLARIN YAPISI VE GÜCÜ
Evrende gözle görünür hal alan her şey, bütün maddeler sayılamayacak kadar çok atomun gibi farklı şekillerde bir araya gelmesiyle oluşuyor. Peki atomlar nasıl bir araya geliyor? Gelin atomların dünyasında neler olduğuna bir göz atalım.
Atomları bir araya getiren şey elektrik yüküdür. Evet atomlar elektrik yükü yoluyla bir araya gelebiliyor. Her atomun merkezinde bir çekirdek var. Bu atom çekirdeği, proton ve nötron denilen parçacıklardan oluşuyor.
Proton pozitif yüklü parçacıklardır nötronlar ise yüksüzdür. Diğer bir deyişle nötr yüklüdürler.
Bu küçük çekirdek denen yapının etrafında da elektron adını verdiğimiz negatif yüklü daha da küçük parçacıklar bulunuyor. Genellikle atomlardaki proton ve elektron sayısı eşittir. Zıt yükleri nedeniyle protonlarla elektronlar birbirlerini çekiyor. İşte atomu bir arada tutan şey de bu. Bu denge sayesinde atomlar elektriksel olarak nötr oluşumlardır.
Ancak küçük bir problem var, bu elektronlar kararsız şeyler:
Sadece kendi atomlarının çekirdeğine değil, bazen başka atomların çekirdeklerine doğru da çekilebilirler. Yani kendi bağlı olduğu yapıya pek sadık sayılmazlar.
Doğru koşullarda bu atomlar arası çekim, birden fazla atomu birbirine bağlayan bir "elektron tutkalı" yaratabiliyor.
Her atomun bağ kurma olasılığı o atomun proton ve elektron sayısına ve dizilimine bağlıdır. Yani bu seviyede işi rastlantılara veya ilahi güçlere bırakamıyoruz.
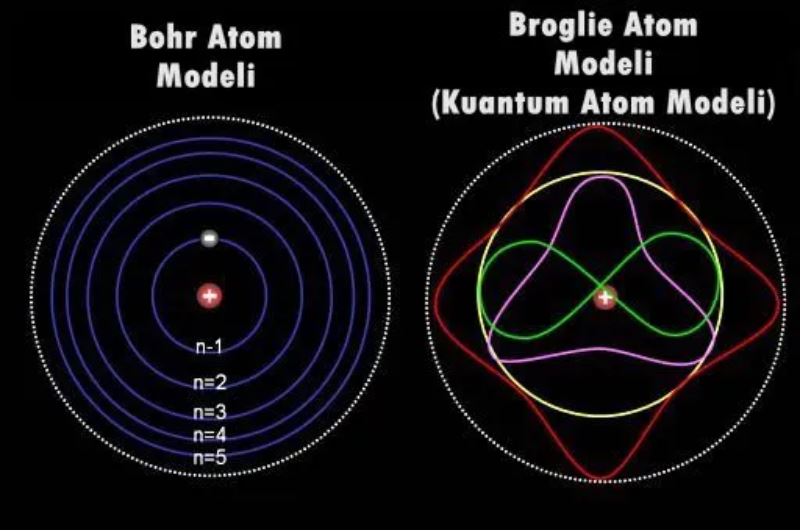
Periyodik tablodaki her element için proton ve elektron sayıları birbirinden farklı. Elektronlar, çekirdeğin etrafındaki "kabuk" adı verilen enerji seviyelerinde bulunuyor. Çekirdeğe en yakın kabuğun enerji seviyesi en düşük, çekirdekten en uzak kabuğun enerji seviyesi ise en yüksek. Her kabukta sınırlı sayıda elektron barınabiliyor. Bu arada kabuk dediğimiz enerji bölgelerinin sınırlarını çizmek ve elektronun nerede olduğunu söylemek hiç kolay değil çünkü gözlem yapılana kadar bilinmezlik içinde dolaşıyor elektronlarımız.
En düşük enerji seviyesindeki kabuk en çok iki elektron, bir sonraki seviye ise en çok sekiz elektron barındırıyor. Maksimum kararlılığa ulaşmak için elektronlar boş yeri olan en düşük enerji seviyesine yerleşiyor.
Kimyasal bağlarda önemli bir faktör, atomların "değerlik kabuğu" denilen en dış kabuğundaki boşlukların sayısı. Doğru boşluk kombinasyonu olduğu zaman elektronlar atomdan atoma sıçrayabiliyor, iki atom aynı elektronu paylaşabiliyor veya birçok atom bir elektron bulutunu paylaşabiliyor. Değerlik kabuğu dolu olduğu zaman atomlar daha kararlı oluyor. Bu nedenle elektronlar, dolu değerlik kabukları oluşturacak şekilde hareket etmeye çalışıyor. Yani bir anlamda sadık olmamakla suçladığımız elektronlar aslında daha stabil moleküler yapılar için hareket etmekteler.
Birden fazla atomun birbiriyle bağ yapmasıyla oluşturduğu yapılara molekül diyoruz.
Moleküller, özdeş atomlardan (aynı elementin atomlarından) oluşabileceği gibi farklı elementlerin atomlarından da oluşabiliyor. En az iki farklı elementten oluşan moleküllere "bileşik" deniyor.
Günlük hayatta kullandığımız malzemeler çok sayıda molekülden oluşur.
Moleküllerin her birinin yapısı ve bu moleküllerin bir araya gelme şekli, malzemenin nasıl bir his vereceğini ve nasıl davranacağını belirliyor.
Moleküller genel olarak üç şekilde bir araya gelebiliyor: gaz, sıvı ve katı. Gazlarda moleküller serbestçe hareket ediyor. Sıvılarda moleküller gevşek bir şekilde bir araya geliyor ve bir kâsedeki bilyeler gibi birbirlerinin üzerinden kayıyor. Katılarda ise moleküller daha katı yapılar hâlinde organize olduğu için serbestçe hareket edemiyor.
Atomların farklı kombinasyonları ve dizilimleri, inanılmaz bir nitelik ve davranış çeşitliliği yaratıyor.
Hatta özdeş atomlarda bile yapısal değişiklikler büyük farklar yaratabiliyor. Örnek olarak elmas ve grafitten bahsedebiliriz. Her ikisi de karbon atomlarından oluşuyor ama grafit, kurşun kalem yapımında kullanılan değersiz bir materyal.
Elmasta güçlü kovalent bağlar atomları katı bir kafes yapısında bir araya getiriyor. Sonuçta dünyanın en sert ve sağlam malzemelerinden biri ortaya çıkıyor. Grafitte ise karbon atomları tabakalı bir yapıda diziliyor ve tabakalar arasındaki bağlar çok zayıf. O kadar zayıf ki kurşun kalemi kâğıda sürterek o bağları koparabiliyoruz. Atomların farklı yapılar hâlinde bir araya getirilip dizilebilmesi akla hayale gelmeyecek olasılıklar sunuyor. Bilim insanları ve mühendisler bu şekilde binlerce yeni malzeme geliştirdi ve olası kombinasyonlar tükenecek gibi değil.
Atomların bir araya gelmesini sağlayan kimyasal reaksiyonların da bazı faydaları var. Örneğin ateş, odundaki (veya başka bir yakıttaki) kimyasal bileşiklerle atmosferdeki oksijen arasında gerçekleşen ve yoğun ısı ile tetiklenen kimyasal bir reaksiyonun sonucu. Yanan odun, kömürleşmiş artıkların yanı sıra hidrojenden, karbondan ve oksijenden oluşan gaz bileşikleri üretiyor. Gazlar ısındıkça bileşikler parçalanıyor ve atomlar havadaki oksijenle yeniden birleşerek su, karbondioksit, karbonmonoksit ve azot üretiyor. Bu süreçte ısı ve ışık biçiminde büyük miktarda enerji açığa çıkıyor.
Atomları manipüle etmek insan teknolojisinin daima merkezinde yer almıştır. Atomların varlığından haberdar olmadığımız zamanlarda bile yeni malzemeler oluşturmak ve enerji üretmek için atomları kullanıyorduk.
Son yıllarda bilim insanları yeni atomlar üretmeyi başardılar: Mevcut çekirdekleri yeni süper ağır çekirdeklerle birleştirerek doğada bulunmayan 20 element yarattılar. Bu insan yapımı atomlar hemen parçalanıyor ama kararlı varyasyonları da çok uzakta olmayabilir. Ne de olsa, atom çekirdeğinin iç enerjisini açığa çıkardıktan sonra nükleer enerji santrallerini ve atom bombalarını yapmamız yüz yıl bile sürmedi.
Günümüzde fizikçiler atomları oluşturan daha da küçük bileşenleri (kuarklar, leptonlar ve bozonlar) araştırıyor. Hâlâ gizemini koruyan bu alandaki yeni bulgular, evren anlayışımızı bile baştan yazabilir.
Levent Aslan
24 Ocak 2025
Bu kitabın imzalı bir fiziki kopyasına sahip olmak için altta bulunan banka bilgilerine ödeme yaptıktan sonra ödeme bildiriminde bulunabilirsiniz










































Yorum Yap